SCLÉRODERMIE SYSTÉMIQUE : ADUSE – Inclusions ouvertes
PROMOTEUR : CHU de Toulouse
INVESTIGATEUR PRINCIPAL/COORDONATEUR :
Dr. Grégory PUGNET
Service de Médecine Interne,
Hôpital Purpan, 1 Place du Docteur Baylac,
31059 Toulouse Cedex 9
Tel : +33-5 61 77 71 26 / Fax : +33-5 61 77 71 24
e-mail : pugnet.g@chu-toulouse.fr
Module Biothérapies CIC 1436 Toulouse :
Hôpital Rangueil, 1 Avenue Jean Poulhès,
31059 Toulouse Cedex 9
Marine LEBRIN-SERRENTINO ; Laetitia BUGAREL ; Fabian GROSS
Tel : 05 61 32 37 24
e-mails : lebrin.m@chu-toulouse.fr ; bugarel.l@chu-toulouse.fr; gross.f@chu-toulouse.fr
TITRE : Injection de cellules souches mésenchymateuses autologues issues de tissu adipeux dans la prise en charge des ulcères digitaux de la sclérodermie systémique.
CLINICALTRIALS : NCT04356755
JUSTIFICATION/ CONTEXT
L’hypothèse de notre étude ADUSE est que l’injection digitale de cellules stromales autologues cultivées dérivées du tissu adipeux pourrait permettre la cicatrisation des UD ischémiques réfractaires induits par la sclérodermie dans une situation clinique où aucun traitement alternatif n’est validé. Ces cellules pourraient également avoir un effet préventif sur l’apparition de nouveaux ulcères digitaux.
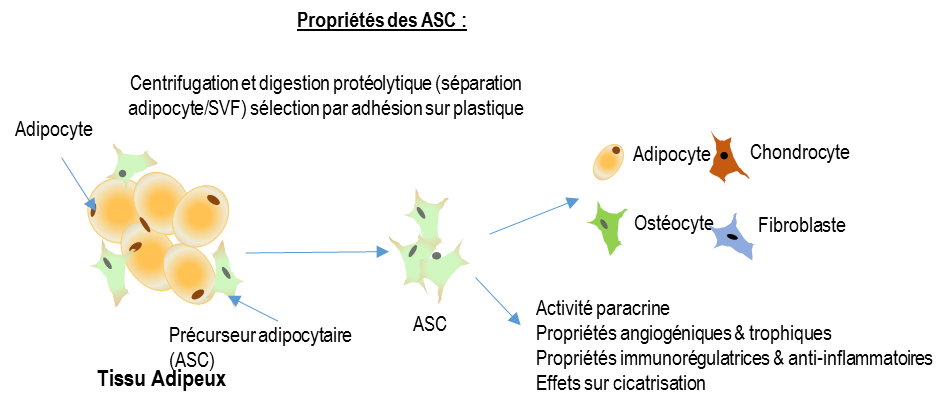
OBJECTIVES
Objectif Principal :
L’objectif principal de cette étude est de comparer l’efficacité et la sécurité à 16 semaines des injections digitales d’ASC autologues versus placebo pour la cicatrisation des ulcères digitaux (UD) réfractaires ischémiques actifs (chronique et/ou récurrent dans les 3 mois suivant l’apparition de l’ulcère digital) chez les patients atteints d’une sclérodermie systémique
Objectifs secondaires :
- Evaluer l’efficacité des injections locales d’ASC autologues sur la cicatrisation des UD, l’absence de complications ou d’apparition de nouveaux UD, et sur la qualité de vie et l’échelle de la douleur des patients.
- Evaluer l’activité immuno-modulatoire et angiogénique des ASC injectées.
- Evaluer le phénotype et le profil cytokinique des ASC injectées.
- Réaliser un immuno-monitoring des biomarqueurs vasculaires et une bio-banque de sérum et de plasma.
DÉROULEMENT DE L’ESSAI
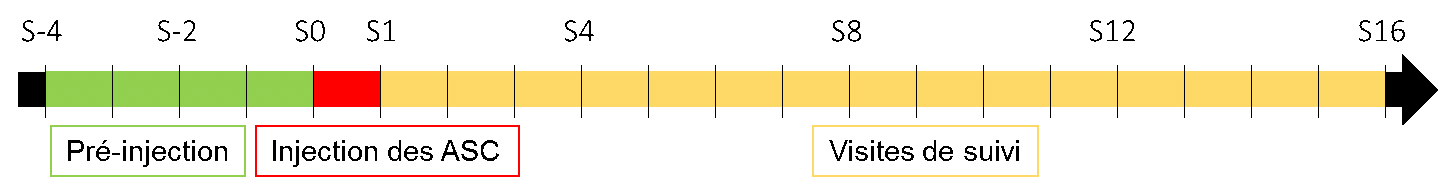
CRITÈRES D’INCLUSION
- Patients majeurs âgés de plus de 18 ans, atteint d’une sclérodermie systémique qui répond aux critères ACR/EULAR 2013
- Patient ayant au moins un ulcère ischémique digital actif, localisé au-delà de l’articulation inter phalangienne proximale (mais non situé sur les calcifications sous-cutanées ou le relief osseux) et réfractaire après 10 ± 2 semaines de traitement standard.
CRITÈRES DE NON-INCLUSION (non-exhaustifs)
- Patient fumeur ou non-fumeur depuis moins de 3 mois
- Patients sous statines, vasodilatateurs, antagonistes des canaux calciques, inhibiteurs de l’ACE, nitroglycérine, α-bloquants adrénergiques, antagonistes des récepteurs adrénergiques ou de l’angiotensine II, N-acétylcystéine ou héparine de bas poids moléculaire depuis moins de 3 mois ou non stable depuis 1 mois.
- Antibiotiques systémiques (par voie orale et IV) permettant de traiter les UD infectées dans les 4 semaines
- Injection locale de toxine botulique dans un doigt dans les 4 semaines
- Sympathectomie chirurgicale des membres supérieurs ou débridement de la plaie de moins d’un mois
- Patient ayant subi une greffe de cellules souches hématopoïétiques (HSCT) autologue
- Patients avec indication d’intensification par HSCT autologue
- Antécédents de cancer au cours des cinq dernières années
- Séropositivité à VIH-1 ou 2, HTLV-1 ou 2, VHB ou VHC
Relatif à chaque UD :
- Ulcère digital dû à des affections autres que la sclérodermie, non ischémique, avec ostéomyélite ou infection cliniquement non contrôlée, infecté nécessitant une antibiothérapie systémique ou nécessitant une intervention chirurgicale urgente.
METHODE : Phase II, multicentrique, prospective, randomisée, contrôlée versus placebo. Les patients seront suivis pendant 16 semaines.

